Il sangue: un tessuto in movimento
Il sangue è un tessuto liquido, contenuto nel sistema cardiovascolare, sottoposto all’azione dinamica del cuore e delle arterie. La parte circolante è distinta da una parte statica contenuta nelle ossa del cranio, nelle vertebre, nelle scapole, nello sterno, nelle ossa del bacino e nelle estremità delle ossa lunghe, dove forma il midollo osseo rosso, distinto dal midollo osseo giallo costituito in prevalenza da adipe..
Il sangue circolante assomma nel neonato a 90 mL/Kg di peso corporeo, nei bambini a 80 mL/Kg di peso corporeo mentre nell’adulto raggiunge circa 70 mL/Kg di peso corporeo, misure che indicano una riduzione progressiva con la crescita corporea del volume totale dovuto alla perdita dello stato di idratazione. E’ composto di due parti: una cellulare, che nei neonati a termine si aggira intorno al 55% del sangue circolante, fra i 6 mesi e i 6 anni di vita intorno al 37%, entro i 12 anni al 40% circa, in un adulto maschio è in media del 45%, in un adulto femmina del 41%; una parte liquida, che ovviamente tende ad aumentare man mano che si passa dall’ età neonatale all’età adulta, composta per il 92% di acqua, che rappresenta il 5% del peso corporeo, e soltanto per l’8% da proteine ed elettroliti. La componente cellulare appare di colore rosso perché è costituito per il 94% da globuli rossi, per poco più del 5% da piastrine e solo per l’1% da globuli bianchi.
Il sangue, a differenza di altri tessuti, è in continuo movimento all’interno dei vasi sanguigni, che si possono assimilare a tubi circolari.
Il modello matematico più semplice e adatto ad interpretare il movimento del sangue nell’apparato circolatorio è espresso dall’equazione di Poiseuille [1]
Q = π ΔPR4(8ηL) -1
dove Q è il flusso volumetrico, ΔP è la differenza di pressione fra gli estremi del vaso, R è il suo raggio, L la sua lunghezza ed η la viscosità. Questa equazione ci dice anzitutto che l’entità del flusso è direttamente proporzionale alla differenza di pressione, per cui nei vasi arteriosi tende a diminuire man mano che si passa dalla macro- alla micro-circolazione, mentre il contrario si verifica nei vasi venosi. La stessa entità del flusso è direttamente proporzionale alla quarta potenza del raggio del vaso, per cui anche piccoli aumenti delle sue dimensioni comportano forti aumenti del flusso. Inoltre, la viscosità è inversamente proporzionale all’entità del flusso in un rapporto tale che a ΔP, R ed L costanti l’aumento di 1/8 dell’unità di viscosità comporta una diminuzione del flusso di una unità. Q si esprime in cm3/sec. In realtà il sangue non si muove in tubi rigidi ma in tubi elastici e ad autoregolazione, per cui in un punto qualsiasi dell’apparato circolatorio il raggio non rimane fisso in ogni momento. La formula più semplice con cui si può valutare la viscosità è la versione semplificata dell’equazione di Einstein per i fluidi viscosi [2] :
η = η plasma(1 + kHt)
dove Ht è il valore della massa cellulare per unità di volume, cioè l’ematocrito e k una costante che dipende dalla temperatura espressa. Si vede chiaramente che la viscosità totale è direttamente proporzionale sia alla viscosità del plasma che all’ematocrito, con la differenza che la variazione di 1 unità di viscosità plasmatica a parità di ematocrito comporta una variazione di 1 unità della viscosità totale, mentre la variazione di una unità di Ht a parità di viscosità plasmatica aumenta di 1.5 punti la viscosità totale. La temperatura influisce nel senso che ogni riduzione unitaria della viscosità è prodotta dalla diminuzione della temperatura di 283 K o 10 °C. Questa grandezza si esprime in centi-Poise. Il modello di Einstein, però, non tiene conto dell’influenza che le dinamiche di flusso hanno sulla viscosità.
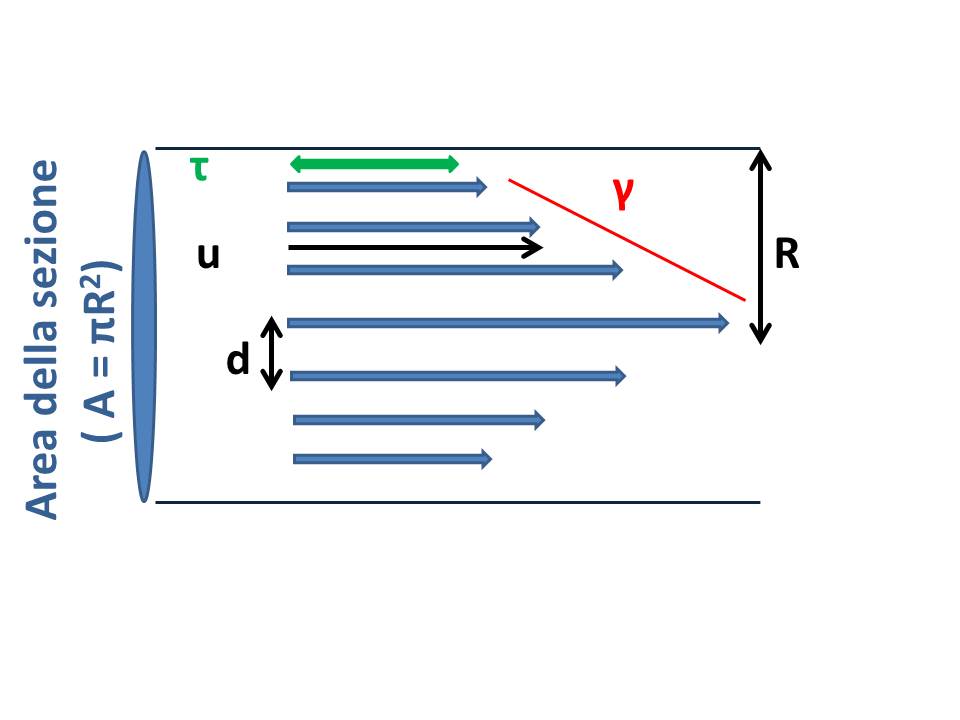
Per capire come la stessa viscosità influisce sul flusso e viceversa bisogna prendere in considerazione altre due variabili fondamentali: lo shear stress (τ) che è la tensione di taglio e lo shear rate (γ) che è il gradiente di velocità, dovute al fatto che aumentando la distanza (d) dal centro del flusso la velocità diminuisce proporzionalmente, in modo che sulla parete è:
γ = [ΔP(R2 – d2)(4ηL)](R – d)-1
e quindi
τ = γη
Una delle equazioni che sono utilizzate per valutare complessivamente lo shear stress del flusso ematico è la versione empirica dell’equazione di Casson [3]:
τ 0.5 = [(Ht-0.1)(CF+0.5)(100)-1 ] 0.5 + (η plasma (1+2.5Ht+7.35Ht2)γ) 0.5
Lo shear stress si esprime in dyne-s/cm2, mentre lo shear rate in sec-1. La velocità di flusso che si valuta all’interno di un vaso, allora, è la velocità media (u) dei vari strati di liquido, che in base all’equazione di Poiseuille è:
u = Q( πR2)-1
per cui
τ = 32ηQ(πR3)-1
dove è evidente che la viscosità apparente è direttamente proporzionale allo shear stress e, quindi, al gradiente di velocità, alle dimensioni del vaso ma inversamente proporzionale al flusso volumetrico in ragione di 32 volte. Le arterie rispetto alle vene e i piccoli vasi rispetto ai grandi vasi hanno valori di shear rate e di shear stress più alti mentre la viscosità apparente aumenta in modo considerevole con la diminuzione del flusso, quindi è più alta nelle vene che nelle arterie e nei piccoli piuttosto che nei grandi vasi. E’, ovvio, che una modificazione della viscosità interna, come da un aumento dell’ematocrito, sarà più sensibile laddove lo shear rate è più alto , cioè dove il flusso volumetrico è più basso. Tutto ciò è vero fino a livello delle arterie terminali e delle vene .
L’80% del calo della pressione massima fra aorta e vena cava si realizza nella microcircolazione, dove la legge di Poiseuille si può riscrivere così [4] :
Q = π dPD4(128ηL)-1
In cui D è il diametro interno del vaso ed è la variabile più importante nel detrminare il valore di Q.
La microcircolazione consta di tre distretti vascolari: le arteriole, i capillari e le venule.
Le arteriole, dove si realizza circa il 50% del calo pressorio all’interno del microcircolo, sono vasi con D massimo fra 25 e 100 μm, dai quali si distaccano rami via via più piccoli. In questi vasi si realizza il fenomeno di Fahraeus-Linqvist [5], secondo il quale la legge di Poiseuille vale fino a vasi con D > 300 μm, poiché la resistenza al flusso volumetrico non aumenta con la diminuzione di D o, se si preferisce, di R, ma, al contrario, diminuisce. Il flusso, cioè, è organizzato secondo un modello a due fasi: una esterna newtoniana priva di cellule ed una interna più vischiosa, cellulata, sempre con caratteristiche newtoniane. Per vasi con D < 30 μm non esiste ancora un modello soddisfacente. Nelle arteriole con D < 60 μm la velocità di flusso non è uniforme e l’eterogeneità aumenta con il diminuire di D. La regolazione principale del flusso risiede nella regolazione di D a livello arteriolare e nelle piccole arterie poste immediatamente prima delle arteriole. I fattori più importanti sono: un meccanismo miogenico, per cui D si riduce se aumenta ΔP e viceversa, sostenuto dal flusso degli ioni calcio e dalle integrine, un meccanismo endoteliale per cui all’aumento dello shear stress aumenta la liberazione di NO, un meccanismo eritroide, dovuto alla perdita di ATP, un potente vasodilatatore, da parte dei globuli rossi che transitano nella microcircolazione, un meccanismo metabolico per il quale, per esempio, la diminuzione della pressione parziale di O2 tessutale o un aumento della CO2, ha effetto vasodilatante, e meccanismi di origine neurale, per cui un aumento dell’attività recettoriale α-adrenergica diminuisce D, mentre una stimolazione β-adrenergica aumenta D.
I capillari sono vasi privi di parete muscolare e presentano dimensioni < 10 μm. Il flusso coincide con la velocità di movimento di 1 globulo rosso e l’ematocrito è notevolmente più basso di quello sistemico. Fra l’endotelio, che è lo strato cellulare più interno al vaso, e il sangue circolante è situato l’ESL, uno strato che guarda il lume vascolare formato da un fluido incomprimibile, una struttura sottostante deformabile a prevalente carica elettrica negativa e da un compartimento ionico mobile. La parte non deformabile è costituita da un complesso di glicosaminglicani di origine endoteliale e da proteine plasmatiche. Lo spessore dell’ESL varia con il variare dello shear stress e dello shaer rate: per velocità di flusso di 0.1 mm/sec è di 1 μm, ma per velocità di 0.4 mm/sec è di appena 0.2 μm. Nel caso di uno spessore di 1 μm in un capillare con D = 6 μm η è pari a 8 volte quella che si riscontra quando il sangue circola in un capillare di vetro dello stesso D.
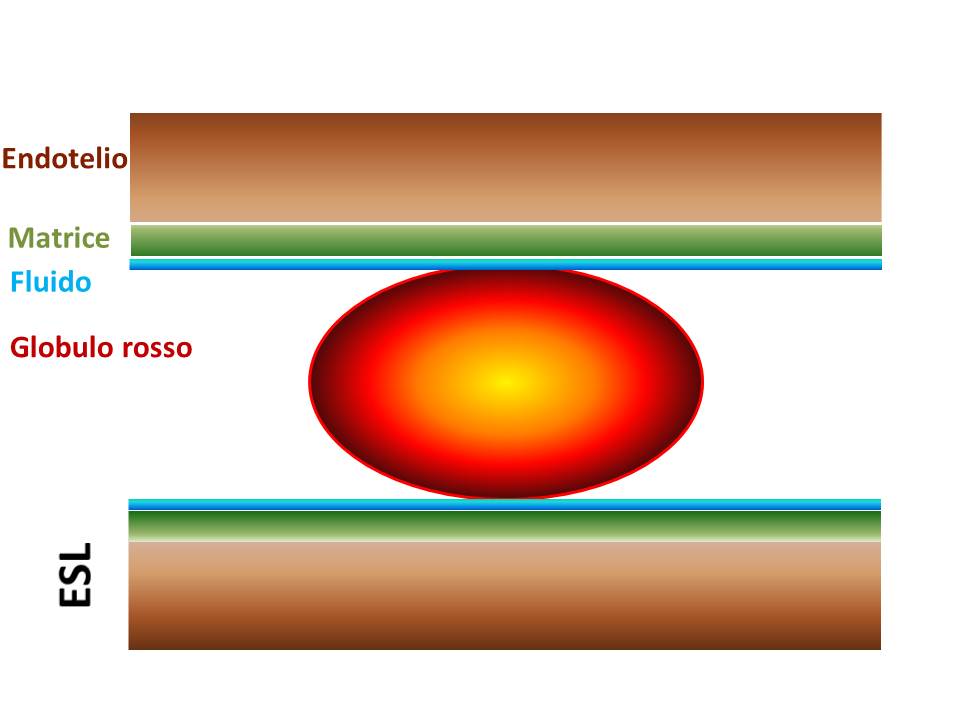
Nelle venule η si raddoppia se dP scende di 5 volte e aumenta soltanto del 60% se dP aumenta di 4 volte. Questo riscontro che conferma il modello di Fahraeus-Linqvist è dovuto all’aggregazione dei globuli rossi e al fatto che i vasi venulari sono molto più corti delle arteriole. Il modello a due fasi è valido anche in questo caso ma lo strato esterno è occupato dai globuli bianchi che sono spinti verso la periferia dagli aggregati eritrocitari situati al centro; questo facilita enormemente tutti i fenomeni biochimici ed elettrostatici che stanno alla base del rolling, dell’adesione e della migrazione trans-endoteliale dei globuli bianchi, tutte azioni che sono concentrate sul versante venulare della microcircolazione. La velocità del flusso presenta un profilo misto ed asimmetrico, nel senso che, al contrario delle arteriole, la fase centrale non è newtoniana e la velocità è fortemente influenzata dalle notevoli variazioni dell’Ht e di η fra vasi venulari. ESL misura soltanto 0.3-0.5 μm e la sua conformazione è tale che la componente plasmatica del sangue è totalmente esclusa. ESL rimane tale anche al crescere di D; si modifica, nel senso che aumenta di spessore solo dopo D > 50μm.
Il flusso sanguigno, a differenza di quanto suppone il modello newtoniano, non si mantiene sempre laminare, ma spesso assume le caratteristiche di un flusso vorticoso. La variabile che lo descrive è il numero di Reynolds [5]:
Re = ρuL(η)-1
che è influenzato direttamente dalla densità (ρ), dalla velocità e dalle dimensioni del diametro del vaso ed inversamente dalla viscosità, per cui il fenomeno della vorticosità, a parità di densità e viscosità del sangue, è più probabile nei vasi più grandi, e più sul versante arterioso che venoso.
Conclusioni: il flusso di sangue all’interno di un vaso, di solito lamellare, dipende dalla differenza di pressione, dalla viscosità e dalle dimensioni della sezione del flusso. La velocità di flusso, in ogni sezione del vaso, è massima al centro, minima sulla parete. La viscosità aumenta in base all’ematocrito, alla temperatura, alla concentrazione del fibrinogeno, ma soprattutto per la diminuzione del diametro. Nella microcircolazione questa regola è contraddetta dal fenomeno di Fahaereus-Linqvist. La probabilità di un flusso vorticoso è maggiore nelle arterie e nei grossi vasi o quando la viscosità è bassa.
Bibliografia
1 – Miller G.E. Fundamentals of biomedical transport processes. Morgan & Claypool Publishers, 2010, pp. 29-30 [full text].
2 – Gordaninejad F., Graeve A.O., Fuchs A., York D. Proceedings of the 10th international conference on electrorheological and magnetorheological suspensions. World Scientific Publishing Co.Ptc.Ltd., 2007, pp. 21-24 [full text]
3 – Galdi G.P., Rannacher R., Robertson A.M., Turner S. Hemodinamical flows. Modeling, analysis and simulation. Oberwolfach, 2008, pp. 99-100 [full text].
4 – Popel A.S., Johnson P.C. Microcirculation and hemorheology. Annu Rev Fluid Mech, 2005;37:43-69 [full text]
5 – Goldsmith HL, Cokelet GR, Gaehtgens P. Robin Fahraeus: evolution of his concepts in cardiovascular physiology. Am J Physiol 1989; 257:H1005-13 [abstract]
6 – Baskurt D.K., Hardeman M.R., Rampling M.W., Meiselman H.J. Handbook of hemorheology and hemodynamics. IOS Press, 2007, pp. 293-4 [full text]
